und
Vorkommen
- bedeckt große Teile der Erdoberfläche und ist entscheidend für den Klimahaushalt der Erde
- unentbehrlich für alle lebenden Organismen
- Ausgangsstoff für Photosynthese und damit Grundvoraussetzung für das Leben auf der Erde
- Der Magensaft enthält eine ungefähr 15%ige Salzsäure zur Eiweißverdauung und Abtötung von Bakterien (kann Sodbrennen verursachen)
- Ammoniak entsteht bei der Zersetzung und Abbau von Eiweißen (Exkremente)
- Entstehung im Boden durch Oxidation der stickstoffhaltigen Ionen (Stickstoffkreislauf)
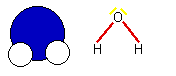
- Molekül aus je einem Sauerstoffatom mit je zwei Wasserstoffatomen
- kleine Moleküle, starke Bindungskräfte zwischen den Molekülen
- Molekül aus je einem Chloratom und einem Wasserstoffatom
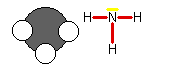
- Molekül aus je einem Stickstoffatom mit drei Wasserstoffatomen

erreichter Edelgaszustand:
- Sauerstoff - Neon
- Wasserstoff - Helium
erreichter Edelgaszustand:
- Chlor - Argon
- Wasserstoff - Helium
erreichter Edelgaszustand:
- Stickstoff - Neon
- Wasserstoff - Helium
- flüssig
- farblos
- geruchlos
- Schmelztemp.:0°C
- Siedetemp.: 100°C
- Dichteanomalie:
(bei 4°C): 1 g/cm3
(bei 0°C) 0,91168 g/cm3
(bei 100°C) 0.804g/cm3
- gutes Lösungsmittel
- nicht elektrisch leitfähig
- gasförmig
- farblos
- stechend riechend
- Schmelztemp.: -114°C
- Siedetemp.: -85°C
- Dichte: 1,639 g/l
- leicht löslich in Wasser (440l HCl in 1l H2O (bildet Salzsäure)
- giftig
- ätzend
- bildet an feuchter Luft Nebel
- gasförmig
- farblos
- stechend riechend
- Schmelztemp.: -78°C
- Siedetemp.: -33,5°C
- Dichte: 0,76 g/l
- sehr gut in wasserlöslich (700l NH 3 in 1l H2O
- stark reizend auf Schleimhaut
- bei gr. Konzentration giftig
- brennt nicht u. fördert Verbrennung nicht
- im Gemisch mit O2 hochexplosiv
- Haushalt: Nahrungszubereitung, Reinigen und Waschen, Geschirrspülen
- Landwirtschaft: Ackerbau und Aufzucht von Tierbeständen
- Industrie: Textilindustrie, Papierherstellung, Lebensmittelindustrie, Pharmazie, Ammoniakherstellung, Kühlmittel, Wärmeüberträger, zum Lösen, Aufschlämmen, Reinigen
- Herstellung von Salzsäure
- Laborsäure
- Herstellung von Chloriden
- Entfernung von Kesselsteinen
- Entkalkung
- Gerben von Leder
- Leimherstellung
- Grundchemikalie zur Herstellung von verschiedenen Stickstoffdüngern, Harnstoff, Salpetersäure und deren Salze (Nitrate)
- Salmiakgeist (NH3-lösung) als Reinigungsmittel im Haushalt
- Wasser entsteht bei der Reaktion von Wasserstoff und Sauerstoff (Oxidation)
- Chlorwasserstoff entsteht bei der Reaktion von Chlor und Wasserstoff (Vorsicht! Knallgas)
- Ammoniak entsteht durch hohe Aktivierungsenergie bei der Reaktion von Stickstoff und Wasserstoff
- 2H2 + O2-->2H2O
- H2 + Cl2-->2HCl
- N2 + 3H 2-->2NH3, bei Verwendung eines Katalysators und bei hoher Temperatur